Thema im Fokus
Entwicklung, Prüfung und Zulassung von Impfstoffen
Bild: Emde Grafik
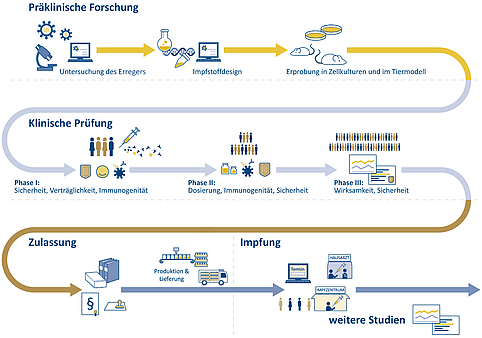
Die Entwicklung eines Impfstoffs kann bis zu 15 Jahre dauern und mehrere hundert Millionen Euro kosten. Sie beginnt mit Grundlagenforschung, in der Wissenschaftlerinnen und Wissenschaftler zunächst herausfinden, welche körpereigene Abwehr ein Erreger hervorruft. Anschließend wird der Frage nachgegangen, wie diese Abwehr auch ohne Infektion mit dem Erreger aktiviert werden kann. Sind die Mechanismen bekannt, muss sich ein Impfstoff zunächst in Labor- und Tierversuchen bewähren, bevor er die klinische Prüfung am menschlichen Organismus durchläuft.
Wirksamkeit und Verträglichkeit eines potentiellen Impfstoffs werden zunächst vorklinisch in Laborversuchen und Tiermodellen getestet. Tierversuche sind für die Entwicklung und Zulassung von Arzneimitteln auf nationaler oder europäischer Ebene vorgeschrieben – vor allem, um Nebenwirkungen zu erkennen. Es ist festgelegt, welche Daten für eine Zulassung vorliegen müssen. Impfstoffe gegen COVID-19 werden zum Beispiel zunächst an Mäusen und Ratten getestet. Untersucht werden über Nebenwirkungen hinaus auch Immunantwort, Dosierung und Impfschema. Durch diese Versuche werden erste Erkenntnisse gesammelt und die Risiken für Probandinnen und Probanden in klinischen Studien minimiert.
Abbildung 2: Schematische Darstellung der Impfstoffentwicklung und -bereitstellung. Quellen: vfa, NaLI | Gestaltung: Emde Grafik
Phasen der klinischen Prüfung
Die klinische Prüfung ist in drei Phasen unterteilt. In Phase I wird ein neuer Impfstoff an unter hundert gesunden Erwachsenen getestet. Hier wird vor allem die Sicherheit und Verträglichkeit überprüft, also, ob der Impfstoff frei von schweren unerwünschten Nebenwirkungen ist. An Studien der Phase II sind in der Regel mehrere hundert freiwillige Testpersonen beteiligt. Hier werden die Immunantwort und die Schutzwirkung untersucht sowie die Dosis optimiert. In Phase III werden mehrere tausend Personen einbezogen. In dieser Phase muss ein signifikanter Wirksamkeitsnachweis des neuen Impfstoffes erbracht werden. Es werden Impfschemata überprüft und mögliche Unterschiede in der Wirkung untersucht, die abhängig von Altersgruppen oder Geschlecht auftreten können. Ein neuer Impfstoff wird in allen drei Phasen durchgehend auf seine Sicherheit geprüft.
Erst wenn alle drei klinischen Phasen ohne Komplikationen durchlaufen wurden, kann die Zulassung des Impfstoffs beantragt werden. Alle Impfstoffe oder Medikamente, die in Deutschland verabreicht werden sollen, benötigen eine nationale Zulassung oder eine Zulassung der Europäischen Kommission, die auf den Empfehlungen der Europäischen Arzneimittelagentur (EMA) beruht. Voraussetzung dafür ist ein positives Nutzen-Risiko-Verhältnis: Der Nutzen durch die Impfung muss für die Allgemeinheit größer sein als das Risiko durch mögliche Nebenwirkungen oder langfristige Effekte beim Einzelnen.
„Es geht zunächst um Sicherheit und Verträglichkeit.“
Nach der Zulassung wird weiter geprüft
In Deutschland ist das Paul-Ehrlich-Institut (PEI) für die nationale Zulassung und Überwachung von Impfstoffen verantwortlich. An dem Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel werden die Impfstoffe nach der Zulassung fortlaufend auf Sicherheit, Wirksamkeit und Verträglichkeit kontrolliert. Hierbei werden zum einen Nebenwirkungen geprüft, die von den Herstellern sowie Ärztinnen und Ärzten an das PEI gemeldet werden. Patientinnen oder Patienten können auch selbst online Nebenwirkungen melden. Das PEI untersucht in solchen Fällen, ob und inwieweit ein Zusammenhang mit dem verabreichten Impfstoff besteht. Zum anderen werden Langzeiteffekte evaluiert, denn über langfristige Wirkungen können im Rahmen der Zulassungsstudien noch keine verlässlichen Aussagen gemacht werden. Die Meldungen werden vom PEI zusätzlich an die Europäische Arzneimittelagentur (EMA) weitergeleitet, die die Daten aus den Mitgliedsstaaten der EU zusammenträgt und vergleicht.
„Es gibt eigentlich auch noch eine Phase vier.“
Finanzierung und gerechte Verteilung
Die Grundlagenforschung für Impfstoffe findet in Deutschland an den Universitäten statt, an Behörden wie dem Paul-Ehrlich-Institut (PEI) oder dem Friedrich-Löffler-Institut (FLI) sowie an den Instituten der Helmholtz-Gemeinschaft, der Leibniz-Gemeinschaft, der Fraunhofer-Gesellschaft oder der Max-Planck-Gesellschaft. Diese Forschung wird durch öffentliche Mittel finanziert. Daneben engagieren sich Stiftungen wie die Bill-und-Melinda-Gates-Stiftung oder der Wellcome Trust.



Abbildung 3: Nationale Durchimpfungsraten bei Masern 2019, d. h. Gabe beider für einen vollständigen Schutz notwendigen Dosen des Masern-Impfstoffs MCV2 bis zum national empfohlenen Alter. Bis Ende 2019 erhielten 71 Prozent der Kinder weltweit zwei Dosen des Masernimpfstoffs gemäß den nationalen Immunisierungsplänen. Quelle: WHO | Gestaltung: Emde Grafik
Kritisch diskutiert wird beim Thema Impfstoffe auch immer wieder über eine gerechte Verteilung und faire Preise. 2000 wurde die Globale Allianz für Impfstoffe und Immunisierung (GAVI) gegründet. Sie ist einer der größten Abnehmer von Impfstoffen weltweit und setzt sich dafür ein, dass Entwicklungs- und Schwellenländer leichter Zugang zu Impfungen bekommen. In der Allianz sind Regierungen vieler Länder vertreten, darunter die deutsche Bundesregierung, sowie die WHO, das Kinderhilfswerk der Vereinten Nationen UNICEF, die Weltbank, die Bill-und-Melinda-Gates Stiftung sowie Impfstoffhersteller und Nichtregierungsorganisationen.
„Es muss gewährleistet sein, dass das Preisniveau stimmt.“
Empfehlungen statt allgemeine Impfpflicht
Empfehlungen, welche Impfungen für welche Bevölkerungsgruppen sinnvoll sind, spricht auf globaler Ebene die WHO aus. Für die Europäische Union (EU) gibt es den Europäischen Impfaktionsplan (EVAP). In Deutschland werden Impfempfehlungen von der Ständigen Impfkommission (STIKO) veröffentlicht. In diesem Gremium sitzen unabhängige wissenschaftliche Expertinnen und Experten, die vom Bundesministerium für Gesundheit und den Landesgesundheitsbehörden berufen werden. Die STIKO-Empfehlungen bilden die Basis für den Nationalen Impfplan (NIP). Darin formulieren Bund und Länder Ziele für Impfquoten, legen die Umsetzungsstrategien und Verantwortlichkeiten fest.
Eine generelle Impfpflicht gibt es in Deutschland nicht. Denn die Impfung berührt die körperliche Unversehrtheit, die nach Artikel 2 des Grundgesetzes besonders geschützt ist.
„Wir haben eine Pflicht aus ethischen Gründen klar ausgeschlossen.“
In Deutschland kann bei hochansteckenden Krankheiten gesetzlich festgelegt werden, dass bestimmte Personengruppen eine Immunität oder Impfung nachweisen müssen – so bei Masern. Laut Masernschutzgesetz von 2020 müssen Kinder vor der Aufnahme in eine Kindertagesstätte oder Schule eine Impfung oder Immunität gegen Masern nachweisen. Dies gilt ebenso für Beschäftigte in Arztpraxen, Krankenhäusern und Tagespflege, für Lehrerinnen und Lehrer, Erzieherinnen und Erzieher sowie für Bewohnerinnen, Bewohner und Mitarbeitende in Flüchtlingsunterkünften.
Dieses Vorgehen hatte 2019 auch der Deutsche Ethikrat empfohlen. In der Stellungnahme „Impfen als Pflicht?“ wurde von einer allgemeinen moralischen Pflicht zur Masernimpfung gesprochen, die Einführung einer gesetzlichen Impfpflicht jedoch lediglich für Berufsgruppen in besonderer Verantwortung empfohlen.
„Es kann Gründe geben für eine berufsspezifische Impfflicht.“
Impfvertrauen in der Bevölkerung
Der Erfolg von Schutzimpfungen ist auf das Vertrauen der Bevölkerung in deren Wirksamkeit und Sicherheit angewiesen. Er hängt daher von einer transparenten Kommunikation der Wirkung von Impfstoffen ab. Weltweit ist dies eine enorme Herausforderung. Die WHO hat mangelnde Impfbereitschaft im Jahr 2019 als eine der zehn größten Bedrohungen für die globale Gesundheit bezeichnet.
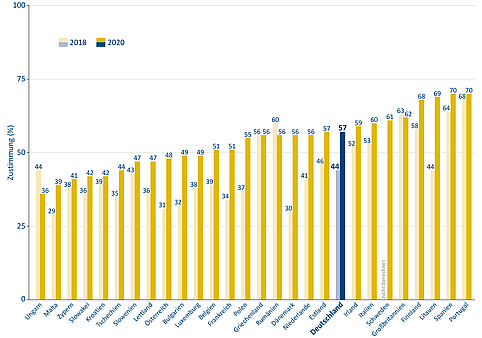
In Deutschland sind generelle Impfgegner eine Minderheit. Ein Großteil der Bevölkerung hält Impfungen grundsätzlich für sehr wichtig. Laut einer repräsentativen Umfrage der Bundeszentrale für gesundheitliche Aufklärung von 2018 können 77 Prozent der Menschen im Alter zwischen 16 und 85 Jahren als Impfbefürworter bezeichnet werden. 17 Prozent haben teilweise Vorbehalte und sechs Prozent lehnen eine Impfung ab. Der Anteil der Impfbefürworter ist damit in den letzten Jahren gestiegen. 2012 lag er noch bei 61 Prozent. Auch in den meisten anderen europäischen Ländern ist die Impfbereitschaft in den letzten Jahren laut Umfragen im Auftrag der Europäischen Kommission gestiegen.
Abbildung 5: Allgemeines Impfvertrauen der Bevölkerung in den EU-Staaten und in Großbritannien laut Umfragen von 2018 und 2020. Quelle: Vaccine Confidence Project, European Commission | Gestaltung: Emde Grafik
Ein besonders hohes Vertrauen besteht hierzulande in etablierte Impfungen gegen Kinderkrankheiten. Der Großteil der Eltern hält diese Schutzimpfungen für Kinder für wichtig, entsprechend hoch sind die Impfquoten. Bei Eintritt in die Schule haben mehr als 90 Prozent der Kinder die von der STIKO empfohlenen Impfungen erhalten. Impfungen gegen Kinderkrankheiten sind seit Jahrzehnten etabliert, die Impfstoffe schon lange im Einsatz, das Wissen über den Nutzen der Impfungen ist weit verbreitet. Den Impfstoffen wird vertraut, ihre Sicherheit ist belegt.
Bei Impfungen gegen die saisonale Grippe ist das von WHO und Europäischer Kommission vorgegebene Ziel einer Impfquote von 75 Prozent in der Altersgruppe ab 60 Jahren auch in Deutschland bislang nicht erreicht. In der Saison 2018/2019 waren laut STIKO nur rund 35 Prozent dieser Gruppe geimpft. Während der Coronavirus-Pandemie ist die Bereitschaft, sich gegen Grippe impfen zu lassen, gestiegen. Die Menschen möchten eine Erkrankung angesichts des belasteten Gesundheitssystems vermeiden.