Thema im Fokus
Erkenntnisse und Nutzen der Embryonenforschung
Bild: PINO NOA – Pia Bublies & Nora Coenenberg, Hamburg
Frühe menschliche Embryonen sind mikroskopisch kleine Zellansammlungen, die auch im Labor erzeugt werden können – zum Beispiel im Rahmen der künstlichen Befruchtung. Die Forschung mit Embryonen kann wichtige Erkenntnisse darüber liefern, wie sich das menschliche Leben in den ersten Tagen nach der Befruchtung entwickelt. Diese Erkenntnisse können für das Erkennen und Behandeln von Krankheiten nützlich sein und die Fortpflanzungsmedizin sicherer gestalten.
In der Embryonenforschung werden wenige Tage alte Embryonen verwendet, die im Rahmen einer fortpflanzungsmedizinischen Behandlung entstanden sind und noch nicht in die Gebärmutter übertragen wurden. Diese Embryonen werden häufig auch als Präembryonen bezeichnet. Hierbei handelt es sich um mikroskopisch kleine Zellansammlungen, die aus der Befruchtung einer menschlichen Eizelle hervorgegangen sind. Seit über 30 Jahren können solche frühen Embryonen auch „in vitro“, das heißt im Labor erzeugt werden, beispielsweise im Rahmen der künstlichen Befruchtung. Embryonenforschung ist ein anerkanntes Forschungsfeld und wird international praktiziert.
Unter natürlichen Bedingungen („in vivo“) kann sich sechs bis zehn Tage nach der Befruchtung einer Eizelle durch ein Spermium der hieraus entstehende Embryo in die Gebärmutter einnisten. In dieser Phase erfolgt im Körper eine mehrstufige Qualitätskontrolle: Es stellt sich heraus, ob die Kombination des mütterlichen und väterlichen Erbguts funktionsfähig ist und ob der Embryo in der Lage ist, die weitere Entwicklung zu einem menschlichen Individuum zu durchlaufen. Bereits in den ersten Tagen nach der natürlichen Befruchtung stirbt etwa jeder zweite Embryo ab, weil er auf Grund von Chromosomenfehlverteilungen oder Mutationen nicht überlebensfähig ist. Es wird angenommen, dass nur jede dritte bis vierte befruchtete Eizelle unter natürlichen Bedingungen zu einer Lebendgeburt führt. Auch bei einer Befruchtung in vitro ist derzeit nur etwa jeder vierte Embryo voll entwicklungsfähig.
Die Erforschung der frühen menschlichen Embryonalentwicklung liefert wichtige Erkenntnisse über die Entwicklungsbiologie des Menschen. Man erhofft sich davon neue Wege, Unfruchtbarkeit, Fehlgeburten, Frühgeburten, genetisch bedingte Erkrankungen oder Fehlbildungen beim Kind vermeiden oder besser behandeln zu können.
„Für einige Forschungsfragen sind menschliche Embryonen notwendig.“
Die frühe embryonale Entwicklung
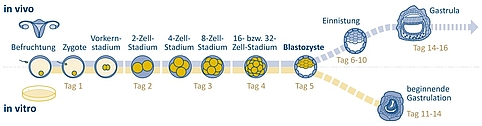
Bei der Befruchtung dringt ein Spermium im Eileiter der Frau in die Eizelle ein. Spermium wie Eizelle besitzen jeweils einen Chromosomensatz. In vitro, das heißt unter künstlichen Bedingungen im Labor, können die Spermien entweder eigenständig in die Eizelle eindringen oder werden injiziert. Bei der Vereinigung von Eizelle und Spermium entsteht eine Zelle mit einem vollständigen doppelten Chromosomensatz: die Zygote. Die jeweiligen elterlichen Genome bleiben anfangs noch in den Vorkernen, die aus den Zellkernen von Samen- und Eizelle entstanden sind.
Abbildung 1: Ablauf der frühen menschlichen Embryonalentwicklung im Körper der Frau und in vitro unter Laborbedingungen. Die In-vitro-Forschung an überzähligen Embryonen bis Tag 14 ist innerhalb enger Grenzen in einigen Ländern, wie etwa den USA, Israel, Schweden, Großbritannien, Frankreich oder Japan, erlaubt. In Deutschland ist diese Art der Forschung derzeit verboten. | Gestaltung: Emde Grafik
Nun beginnt die Zellteilung. Beobachtungen in Mausembryonen legen nahe, dass erst im 2-Zellstadium eine vollständige Durchmischung der elterlichen Chromosomen stattfindet. Dafür müssen sich die Membranen der Vorkerne auflösen. Die resultierenden Zellkerne enthalten sowohl den mütterlichen als auch den väterlichen Chromosomensatz.
Im 4-Zell-Stadium beginnt die Aktivierung des embryonalen Genoms. Diese ist wesentlich für die Proteinsynthese und den Fortgang der Zellteilungen. Nach einer weiteren Zellteilung verlieren die Zellen in dem darauffolgenden 8-Zell-Stadium durch die beginnende Differenzierung allmählich ihre Totipotenz und werden pluripotent. Pluripotente Zellen besitzen das Potential, sich in sämtliche Gewebetypen des Körpers zu differenzieren. Sie können sich im Unterschied zu totipotenten Zellen nicht mehr zu einem eigenständigen Organismus entwickeln.
Besteht die Zellkugel aus 16 beziehungsweise 32 Zellen, wird sie als Morula bezeichnet. Diese teilt sich weiter und erreicht unter natürlichen Bedingungen etwa vier Tage nach Befruchtung die Gebärmutter. Es kommt zur Verlagerung eines Teils der Zellen ins Zentrum der Morula, während der andere Teil außen bleibt. Am Tag fünf besteht der Embryo aus etwa 60 bis 100 Zellen. Sie werden flacher und kompakter und bilden schließlich eine Hohlkugel aus zwei Zellschichten, die Blastozyste.
Gewöhnlich wird der Embryo bei einer In-vitro-Fertilisation (IVF), also der künstlichen Befruchtung, in diesem Stadium die Gebärmutter übertragen. Die Besonderheit der IVF besteht also darin, dass sich der menschliche Embryo zunächst bis zu sechs Tage außerhalb des Körpers befindet und daher künstlichen Wachstumsbedingungen ausgesetzt ist.
Um weiter wachsen zu können, muss sich die Blastozyste zwischen Tag sechs und zehn in der Gebärmutterwand einnisten. Nur in der Gebärmutter kann die Entwicklung des Embryos zum Fötus voranschreiten, von dem man ab Tag 70 spricht, wenn alle Organe und Extremitäten angelegt sind. Zunächst beginnt dafür nach wenigen Tagen die Gastrulation des Embryos: Es bilden sich die Keimblätter aus. Aus diesen entsteht schließlich der neue menschliche Organismus (auch als „embryo proper“ bezeichnet), während die ihn umgebenden Zellen Eihülle und Plazenta bilden. Der Anfang der Gastrulation kann inzwischen auch unter künstlichen Bedingungen herbeigeführt werden. Der Embryo erreicht hierbei in vitro etwa das Stadium von Tag elf der natürlichen Entwicklung und ist dann etwa 0.3 Millimeter groß.
„Zu hochrangigen Forschungszwecken zählt auch die Grundlagenforschung.“
Weiterentwicklung der Fortpflanzungsmedizin
Neben grundlegenden Fragen zur Embryonalentwicklung und frühen Krankheitsentstehung kann Embryonenforschung auch bei der Beantwortung wichtiger Fragen der Fortpflanzungsmedizin helfen. Sie kann etwa dazu beitragen, Unfruchtbarkeit besser zu erkennen und zu behandeln, die Überlebensfähigkeit und gesunde Entwicklung von Embryonen beziehungsweise Föten in der Schwangerschaft zu verbessern und Fehl- sowie Frühgeburten zu verhindern.
Ein Beispiel hierfür ist die Erforschung von Abweichungen der Chromosomenzahl (Aneuploidien) bei frühen Embryonen in einigen oder allen ihren Zellen. Aneuploidien sind für etwa ein Drittel der untersuchten Fehlgeburten verantwortlich und damit vermutlich die häufigste Ursache spontaner Schwangerschaftsbeendigungen. Ein besseres Verständnis der Ursachen für die hohe Rate von Aneuploidien bei menschlichen Embryonen ist notwendig, um Paare, die deswegen unter Unfruchtbarkeit oder wiederholten Fehlgeburten leiden, beraten und behandeln zu können.
Auf Grundlage internationaler Forschungsergebnisse konnten bereits fortpflanzungsmedizinische Behandlungen verbessert und sicherer gestaltet werden. Ein Beispiel hierfür ist der elective Single-Embryo-Transfer (eSET) im Rahmen einer künstlichen Befruchtung. Bei dieser Methode wird eine größere Zahl von Eizellen befruchtet und der Embryo mit der höchsten Entwicklungschance der Frau übertragen. Auf diesem Wege kommt es bei annähernd gleichen Erfolgsaussichten sehr viel seltener zu risikobehafteten Mehrlingsschwangerschaften. In Großbritannien flossen diese Forschungserkenntnisse systematisch in eine Verbesserung der Behandlungsqualität bei der IVF ein. Ergebnis ist, dass innerhalb von zehn Jahren die Zahl der Mehrlingsschwangerschaften und damit auch schwerwiegende Frühgeburtsrisiken für Mutter und Kind deutlich reduziert werden konnten. In Großbritannien etwa liegt die Zwillingsrate pro Geburt bei der IVF dank des eSET-Verfahrens bei etwa 10 Prozent, in Schweden bei nur 4 Prozent. In Deutschland, wo das Verfahren verboten ist, führt etwa jede fünfte IVF-Behandlung zu einer Zwillingsschwangerschaft.
Stammzellen für die personalisierte und regenerative Medizin
Humane Stammzellen aus frühen Embryonen (hES-Zellen) können sich aufgrund ihrer Pluripotenz zu jedem Zelltyp entwickeln und sämtliche Gewebetypen des Organismus bilden. Sie bergen daher ein großes Potential für die regenerative und personalisierte Medizin. Erstmals Ende der 1990er Jahre gelang es, solche Stammzelllinien aus humanen embryonalen Zellen zu gewinnen. Seither knüpfen sich viele Hoffnungen an die Forschung mit diesen Zelllinien, insbesondere für die Zellersatztherapie, also die Reparatur geschädigten Gewebes. Aktuell werden etwa klinische Studien zur Behandlung altersbedingter Makuladegeneration, einer Form schwerer Sehschwäche, mittels Zelltherapie durchgeführt. Auch bei der Behandlung von Volkskrankheiten wie Diabetes, Arthrose, Herzinfarkt oder Schlaganfall setzt die Forschung auf hES-Zellen. Die Gewinnung von hES-Zellen führt zum Verlust des Embryos in vitro und ist in Deutschland derzeit verboten. Hierzulande ist allerdings ein Import embryonaler Stammzellen aus anderen Ländern in einem engen gesetzlichen Rahmen möglich.
Bestehende hES-Zelllinien wurden zum Teil über Jahre kultiviert und haben dabei genetische und epigenetische Veränderungen angehäuft. Sie können zudem mit Krankheitserregern wie Prionen oder Mykoplasmen kontaminiert sein. Für die klinische Anwendung wäre es daher notwendig, neue hES-Zelllinien unter genau definierten Bedingungen zu generieren.
Grundlagenforschung zu Gentherapien
Ein weiteres wesentliches Anwendungsfeld medizinischer Forschung betrifft die genetische Korrektur bei erblichen Erkrankungen mittels Genomeditierung. Abhängig von der Erkrankung gibt es zwei unterschiedliche Vorgehensweisen: die genetische Korrektur von Körperzellen (somatischen Zellen) oder ein Eingriff in das embryonale Genom in vitro. Die somatische Gentherapie wird bereits seit vielen Jahren klinisch erprobt. Sie ist normalerweise auf den zu behandelnden, in der Regel bereits erkrankten, Menschen beschränkt.
Wenn etwa Eizellen und Spermien oder deren Vorläufer einer Gentherapie unterzogen werden, finden Eingriffe in die Keimbahn statt. Diese wirken sich potentiell auch auf nachfolgende Generationen aus, da die genetische Veränderung vererbt werden kann. Die internationale wissenschaftliche Gemeinschaft ist sich überwiegend einig, dass Keimbahneingriffe mit dem Ziel, die Geburt eines Menschen herbeizuführen, aufgrund der noch unbekannten Risiken und möglicher Alternativen wie somatische Gentherapie, Präimplantationsdiagnostik und Adoption derzeit nicht gerechtfertigt sind. Als im Jahr 2018 in China Zwillinge geboren wurden, deren Erbgut bei der Befruchtung gezielt durch die Genschere CRISPR/Cas9 verändert wurde, löste dieser Fall in der wissenschaftlichen Gemeinschaft daher große Empörung aus.
Um zumindest die Chancen und Risiken dieser Form der Gentherapie kritisch überprüfen und bewerten zu können, wäre eine entsprechende Grundlagenforschung an Keim- und Körperzellen ebenso wie an frühen menschlichen Embryonen hilfreich. Insbesondere könnten die nach wie vor mit der Methode verbundenen unbeabsichtigten Effekte (Off-target-Effekte), wie Verluste von DNA-Sequenzen oder Chromosomen, besser abgeschätzt und möglicherweise verhindert werden.
Veröffentlicht: Mai 2021