Thema im Fokus
Pflanzen genetisch verändern – die Verfahren im Überblick

Bild: Adobe Stock / vitstudio
Im Bemühen um gute landwirtschaftliche Erträge war die Menschheit schon immer erfinderisch. Bereits durch Selektion nützlicher natürlich auftretender Genveränderungen hat sie das Erbgut von Getreide und anderen Nutzpflanzen beeinflusst. Gentechnik ermöglicht es, Erbmerkmale gezielt zu übertragen. Die Genomeditierung präzisiert und vereinfacht derartige Anwendungen.
Seit rund 12.000 Jahren betreiben Menschen systematisch Ackerbau. Die ersten Pflanzenzüchterinnen und Pflanzenzüchter lebten im vorderasiatischen Mesopotamien zwischen den Flüssen Euphrat und Tigris. Das Gebiet gehört heute größtenteils zum Irak und zu Syrien. In dieser Region ließen sich Menschen nach heutigem Wissen erstmals dauerhaft nieder und bauten zum Beispiel Gerste, Emmer und Urformen des Weizens an. Indem einzelne Pflanzen – beispielsweise solche, deren Samen eher spät ausfallen – für die nächste Aussaat genutzt wurden, fand eine Selektion von Menschenhand statt.
Auf diese Weise wurden genetische Veränderungen lange vor den ersten Erkenntnissen über das Erbgut oder molekularbiologische Vorgänge in den Zellen genutzt und vorangetrieben. Denn Mutationen treten auch ohne menschliches Zutun immer wieder auf. Sie kommen bei allen Lebewesen durch Kopierfehler bei der Verdopplung, Weitergabe und Reparatur des Erbguts zustande oder durch Umwelteinflüsse wie Sonnenstrahlung und Sauerstoffradikale im normalen Stoffwechsel. Die meisten dieser Genveränderungen haben keine nennenswerten Effekte, einige sind sogar von Nachteil für das Überleben der Pflanze und die Weitergabe ihrer Erbinformationen an die nächste Generation. Nur bei weniger als einem Prozent natürlicher Mutationen entstehen vorteilhafte neue Eigenschaften. Dies ist eine der Triebkräfte der Evolution.
Die Landwirtinnen und Landwirte der Steinzeit entdeckten auch, dass es förderlich sein kann, verwandte Arten in das Getreide einzukreuzen, beispielsweise Wildgräser. Heutige molekularbiologische Untersuchungen zeigen, dass Menschen durch klassische Züchtung das Erbgut von Kulturpflanzen bereits seit Tausenden Jahren veränderten. Es kam nicht nur zu Mutationen an einzelnen Stellen, sondern es gingen auch ganze Teile des Erbguts verloren oder platzierten sich anderswo. Nachgewiesen ist auch, dass sich im Zuge der Züchtung manche Gensequenzen vervielfachten – und dass sich Genabschnitte von nicht verwandten Arten eingefügt haben.
„Menschen machen sich Mutationen von Pflanzen seit Jahrtausenden zunutze. Unsere heutigen Kulturarten sind kontinuierlich an die Wünsche des Menschen angepasst worden.“
Fortschritte der Pflanzenzucht
Systematischer wurde die Pflanzenzucht ab Ende des 19. Jahrhunderts mit den Erkenntnissen Gregor Johann Mendels (1822–1884) über die Kreuzungsgenetik. Der österreichische Augustiner-Priester und Naturforscher hatte nach jahrelangen Experimenten mit Erbsenpflanzen im Garten der Abtei St. Thomas in Brünn im heutigen Tschechien die Gesetze der Vererbung aufgeklärt. Mendel erkannte, dass es bei Erbsen von jedem Erbmerkmal zwei Kopien gibt: eines von der Mutterpflanze, das andere von der Vaterpflanze. Und er beobachtete, dass dominante und rezessive Merkmale existieren, also solche, die sich stets durchsetzen und andere, die nicht immer in Erscheinung treten. Seine bahnbrechenden Erkenntnisse – er gilt heute als „Vater der Genetik“ – fanden zu Lebzeiten des Forschers kaum Anerkennung. Erst Anfang des 20. Jahrhunderts wurden seine Vererbungsgesetze wiederentdeckt und ihre Tragweite erkannt.
Mit dem Wissen über die Vererbungsregeln konnten Pflanzen zielgerichteter gezüchtet werden. Die Etablierung von Zellkulturtechniken Anfang des 20. Jahrhunderts, die eine Selektion im Labor ermöglichten, und Hybridzüchtungen waren weitere Fortschritte. Bei der Hybridzüchtung werden zwei reinerbige Elternlinien miteinander gekreuzt – also solche, bei denen beide Kopien eines Gens gleich sind. Auf diese Weise entsteht in bestimmten Fällen eine besonders robuste und ertragreiche neue Generation. Deren Nachkommen weisen die positiven Merkmale allerdings nicht mehr in allen Individuen auf. Aus diesem Grund müssen Landwirtinnen und Landwirte Saatgut von Hybridsorten jedes Jahr neu erzeugen oder kaufen.
Seit Mitte des 20. Jahrhunderts hat sich die Mutationszüchtung bei Pflanzen etabliert und wird bis heute praktiziert. Dabei werden auf künstliche Art zufällige Veränderungen im Erbgut ausgelöst, wodurch sich die genetische Ausgangsbasis für die Züchtung verbreitert. Meist werden hier die Pflanzensamen ionisierender Strahlung (Röntgen- oder Neutronenstrahlen) ausgesetzt, die Mutationen auslöst. Die entstandenen Mutanten werden hinsichtlich interessanter Gene beziehungsweise Eigenschaften untersucht, die dann in vorhandene Sorten eingekreuzt werden können. Weltweit sind bereits mehr als 3.000 neue Sorten von Kulturpflanzen mithilfe von Strahlung gezüchtet worden. Zu den Produkten gehören ein Großteil der Hartweizensorten, die für die Herstellung von Pasta verwendet werden, viele andere Getreidesorten sowie Sorten von Obst, Gemüse und Hülsenfrüchten.
Neuere Verfahren verwenden anstelle der ionisierenden Strahlung Chemikalien wie Ethylmethansulfonat, die Gene verändern können. Sie lassen sich mit systematischen DNA-Analysen kombinieren, um schneller herauszufinden, ob die erwünschte Genveränderung erreicht wurde. Dazu müssen die Forscherinnen und Forscher jedoch zuvor wissen, welche Veränderungen aufgespürt werden sollen. TILLING nennt sich die Kombination aus chemischer Mutagenese und anschließendem Genom-Screening, das Akronym steht für Targeting Induced Local Lesions in Genomes (gezielt induzierte lokale Läsionen in Genomen).
Die Ära der klassischen Gentechnik
Es waren Experimente an Tabakpflanzen, die in den 1980er Jahren einen wichtigen Grundstein für die Grüne Gentechnik legten. Forschenden in Köln und Gent/Belgien gelang es erstmals, ein artfremdes Gen in das Erbgut einer Pflanze zu übertragen. Sie nutzten dazu das Bodenbakterium Agrobacterium tumefaciens, das bis heute eine wichtige Rolle in der Grünen Gentechnik spielt. Diese Bakterienart ist von Natur aus in der Lage, Pflanzen zu infizieren und deren Erbgut zu verändern. Das erfolgt mithilfe der sogenannten Plasmide. Diese ringförmigen DNA-Elemente, über die Bakterien zusätzlich zu dem im Chromosom befindlichen Erbgut verfügen, können über Artgrenzen hinweg in andere Zellen eindringen. Für die Gentechnik lassen sie sich sozusagen als Fähre nutzen, um Erbmaterial zu übertragen. Dazu werden die Plasmide im Labor mit dem gewünschten Gen bestückt.
Diese Methode macht es möglich, einzelne Gene zu transferieren, ohne dass ein Befruchtungsvorgang stattfinden muss. Auf diese Weise lassen sich auch zwischen zwei Pflanzenarten, die nicht kreuzbar sind, Eigenschaften übertragen. Die eingefügten Gene bewirken beispielsweise die Ausprägung einer neuen Eigenschaft, manche verstärken oder schwächen auch ein bereits vorhandenes Merkmal. Seit Mitte der 1990er Jahre werden die Verfahren kommerziell genutzt, nach und nach kamen transgene Nutzpflanzen auf den Markt. Unter den ersten waren Sojabohnen, die gegen ein bestimmtes Herbizid tolerant sind, sowie Mais und Baumwolle, die Schädlinge abwehren können. Pflanzen, in deren Erbgut ein oder mehrere Gene eines ganz anderen Organismus eingebracht worden sind, werden als transgen bezeichnet.
Das Einschleusen von zusätzlichem Erbgut mithilfe von Bakterien-Plasmiden gilt heute als klassische Gentechnik, ebenso die Übertragung von Erbmaterial per Genkanone. Dazu werden winzige Partikel aus Gold oder Wolfram mit dem betreffenden Erbgutabschnitt beladen. Diese Konstrukte werden mit hohem Druck in die Pflanzenzellen eingebracht. Im Anschluss löst sich die DNA von den Partikeln und kann sich in das Genom im Zellkern einfügen. Zur Erfolgskontrolle ist es üblich, Markergene mit zu übertragen, meist Antibiotikaresistenz-Gene. Pflanzenzellen, die mit dieser zusätzlichen Eigenschaft versehen sind, wachsen auch auf antibiotikahaltigem Nährboden und lassen sich dadurch im Labor von Pflanzen unterscheiden, bei denen die Genübertragung nicht funktioniert hat.
Die Anwendung der klassischen Gentechnik
In der Europäischen Union (EU) sind Produkte der Grünen Gentechnik für den Anbau bisher nicht zugelassen, mit Ausnahme der gegen den Maiszünsler resistenten Maissorte MON810. 2020 wurde sie einzig in Spanien und Portugal angebaut, insgesamt auf rund 100.000 Hektar. Weltweit stellt sich die Situation anders dar: 2019 wuchsen auf insgesamt 190 Millionen Hektar gentechnisch veränderte Pflanzen, das sind gut 13 Prozent der Ackerflächen weltweit. Hauptsächlich sind es Sorten von Sojabohnen, Mais, Baumwolle und Raps, die mit klassischen gentechnischen Methoden entwickelt wurden. Zu den Ländern, in denen diese Produkte gemessen an der landwirtschaftlichen Produktion eine besonders große Rolle spielen, zählen unter anderem die USA, Brasilien, Argentinien, Kanada und Indien.
In Indien machen gentechnisch veränderte Baumwollpflanzen 95 Prozent der Baumwollproduktion aus, in Brasilien erfolgt der Sojaanbau zu 95 Prozent mit gentechnisch veränderten Pflanzen. In den USA ist es ähnlich: Hier werden jeweils mehr als 90 Prozent der Flächen für Soja, Mais und Baumwolle mit gentechnisch veränderten Pflanzen bestellt. Bislang spielen beim kommerziellen Anbau von Nutzpflanzen vor allem zwei Merkmale eine Rolle: Herbizidtoleranz und Resistenz gegen Fraßinsekten.
Herbizidtoleranz macht Pflanzen unempfindlich gegenüber einem bestimmten Unkrautbekämpfungsmittel (Herbizid). So kann dieses Mittel auf dem Feld zur Vernichtung von Unkraut verwendet werden, ohne das angebaute Produkt zu gefährden. Ein bekanntes Beispiel sind Sojabohnen, die unempfindlich gegen das Breitbandherbizid Glyphosat sind. Das wird durch Einfügen eines Gens aus dem Bodenbakterium Agrobacterium tumefaciens erreicht. Dadurch bilden die Pflanzen eine andere Form eines bestimmten Enzyms (EPSP-Synthase). In seiner ursprünglichen Form ist dieses Enzym der Angriffspunkt für Glyphosat, das Herbizid hemmt das Enzym. Weil die EPSP-Synthase wichtig für die Bildung von Eiweißbausteinen ist, stellen Pflanzen nach der Behandlung mit dem Mittel ihr Wachstum ein und sterben nach einigen Tagen ab. Glyphosatresistente Sojabohnen besitzen die bakterielle Form der EPSP-Synthase und sind dadurch unempfindlich gegenüber dem Herbizid.
Das Konzept hat jedoch Nachteile, denn viele Unkräuter sind gegen Glyphosat tolerant oder sogar resistent geworden, so dass zum Teil mehr von dem Mittel eingesetzt werden muss, um hohe Ernteerträge zu erzielen. Darüber hinaus wird der Einsatz von Glyphosat mit Blick auf die Folgen für die Biodiversität kritisch gesehen. In Deutschland warnte zum Beispiel das Bundesamt für Naturschutz in einem 2018 veröffentlichten Positionspapier vor erheblichen negativen Auswirkungen auf die biologische Vielfalt insbesondere in der Agrarlandschaft.
Neben der Herbizidtoleranz hat die klassische Grüne Gentechnik häufig zum Ziel, Pflanzen durch Erbgutveränderungen vor Fraßinsekten zu schützen. Zu diesem Zweck wird zum Beispiel das Gen für die Produktion des sogenannten Bt-Proteins übertragen. Es stammt aus dem Bodenbakterium Bacillus thuringiensis und kommt in unterschiedlichen Varianten vor. Es kann Mais vor Schädlingen wie den Raupen des Maiszünsler-Falters schützen sowie gegen die Larven des Maiswurzelbohrers, eine Käferart. Außerdem hilft es gegen Insekten, die Baumwollpflanzen anfressen. Das Bt-Protein entsteht in der Pflanze in einer ungiftigen Form und wird erst im Darm der jeweiligen Schädlinge in eine für diese giftige Variante umgewandelt. Daraufhin bindet es sich an die Darmwand und zerstört sie. Landwirtinnen und Landwirte kommen auf diese Weise mit deutlich weniger Insektiziden aus.
Genomeditierung: Präzise Eingriffe mit der Genschere
Bei den Werkzeugen für die Genomeditierung, umgangssprachlich auch Genscheren genannt, handelt es sich um verschiedene molekulare Systeme, mit denen einzelne Bausteine des Erbguts jeglicher Lebewesen gezielt und präzise umgeschrieben, also gewissermaßen editiert werden können. Dadurch eröffnen sich nicht nur in der Medizin viele neue Möglichkeiten, sondern auch in der Pflanzenzucht. Dort bedeuten sie zudem Zeitersparnis. Schätzungen von Expertinnen und Experten zufolge können je nach Pflanzenart mit Genomeditierung im Vergleich zu konventionellen Züchtungsverfahren zwischen sechs und 50 Jahren eingespart werden.
Der Begriff Genomeditierung umfasst eine Reihe von Verfahren, die seit Mitte der 1990er Jahre entwickelt wurden und zu denen neben der bekannten Genschere CRISPR/Cas auch die molekularen Systeme TALEN, Zinkfinger-Nukleasen und Meganukleasen zählen. Mit diesen Methoden ist es möglich, nahezu jede Stelle in der Erbgutsequenz zielgenau anzusteuern und durchzuschneiden. Die Durchtrennung des DNA-Strangs kann bewirken, dass ein Gen inaktiviert oder verändert wird. Möglich ist ebenso, ein neues Gen an einer bestimmten Stelle einzubauen, um eine Eigenschaft zu verändern oder zu ergänzen. Inzwischen können Forschende mithilfe sogenannter Baseneditoren einzelne DNA-Bausteine sogar gezielt verändern, ohne zuvor den DNA-Strang zu durchtrennen.
Die Programmierung von TALEN und Zinkfinger-Nukleasen ist aufwendig und kostenintensiv. Die CRISPR/Cas-Methode ist vergleichsweise effizient, spart also Zeit und Kosten. Auch aus diesem Grund wird sie heutzutage vorzugsweise in vielen Forschungs- und Entwicklungslaboren genutzt.
„Züchtung wird viel schneller und präziser werden. Ein weiteres attraktives Merkmal der Methoden ist, dass wir dafür keine Fremdgene brauchen.“
Foto: MPI-MP
CRISPR/Cas: ein Immunsystem von Bakterien
Die Abkürzung CRISPR steht für Clustered Regularly Interspaced Short Palindromic Repeats. Gemeint sind kurze, sich wiederholende DNA-Abschnitte. Sie wurden erstmals 1987 bei dem Bakterium Escherichia coli entdeckt. 20 Jahre später stellte sich heraus, dass sie bei zahlreichen weiteren Bakterien vorkommen und Bestandteil eines anpassungsfähigen Immunsystems sind, mit dem diese Lebewesen Viren abwehren.
Viren, die Bakterien befallen können, werden Phagen genannt. Sie dringen in die Bakterienzelle ein und injizieren ihr Erbgut. In der Folge produzieren die Bakterien neue Phagen und gehen meistens zugrunde. Einige Bakterien verfügen über einen Abwehrmechanismus, der sie vor Phagen schützt. Das CRISPR/Cas-System dient ihnen dabei als Immungedächtnis und -abwehr zugleich. Dazu integrieren die Bakterien einen kurzen Abschnitt der Phagen-DNA in die CRISPR-Sequenzen im eigenen Erbgut. Auf diese Weise entsteht eine Sammlung zur Erkennung sämtlicher Erreger, mit denen die Zelle konfrontiert war. Sie wird an die Bakterien-Nachkommen weitergegeben.
Etwa die Hälfte aller heute bekannten Bakterien und fast alle Arten der früher auch als Urbakterien bezeichneten Archaeen besitzen ein CRISPR/Cas-Abwehrsystem. Das bekannteste, CRISPR/Cas9, zählt zu den besonders einfachen Systemen dieser Art. Die CRISPR-Sequenzen im Erbgut stellen die Bauanleitung für kurze Moleküle aus Ribonukleinsäure (RNA) dar, die als Lotsen-Moleküle dienen und den anderen Teil der Genschere, das Cas-Protein, an eine bestimmte Stelle im Erbgut leiten. Durch Veränderung eines Teils dieser Sequenz lässt sich das Prinzip abwandeln und technisch als Genschere nutzen, die gezielt an bestimmten Stellen im Erbgut ansetzt.
Im Prinzip besteht das im Labor verwendete System aus zwei Teilen: der von CRISPR abgeleiteten Lotsen-RNA und dem Schneidewerkzeug Cas. Die Abkürzung Cas steht für CRISPR-associated proteins; es handelt sich dabei um Enzyme. Das häufig genannte Cas9 ist ein Beispiel aus dieser Enzym-Familie. Es spielte bei den Arbeiten über CRISPR an Bakterien der Gattung Streptococcus eine wichtige Rolle. Es gibt noch weitere Cas-Proteine, etwa Cas12 und Cas13, die in der Natur bei anderen Bakterien zu finden sind.
CRISPR/Cas als Werkzeug
Als entscheidendes Jahr für den Durchbruch der CRISPR/Cas-Technologie gilt 2012. In diesem Jahr veröffentlichten die Arbeitsgruppen von Emmanuelle Charpentier (heute Max-Planck-Forschungsstelle für die Wissenschaft der Pathogene in Berlin) und Jennifer Doudna (University of California in Berkeley/USA) ihre Erkenntnisse darüber, wie sich der natürliche Mechanismus, mit dem Bakterien eindringende Viren erkennen und abwehren, für gezielte Eingriffe im Erbgut nutzen lässt. 2020 erhielten die beiden Wissenschaftlerinnen für die Entwicklung dieser Methode der Genomeditierung den Nobelpreis für Chemie.
Nachdem Charpentier und Doudna ihre Versuche mit der Genschere an Bakterien veröffentlicht hatten, wurde die weitreichende Bedeutung ihrer Erkenntnisse schnell deutlich. Andere Forschungsteams zeigten, dass sich die Genschere CRISPR/Cas9 auch im Genom anderer Organismen anwenden lässt, also auch bei Tieren, Menschen und Pflanzen. Interessant an diesem molekularen Werkzeug ist nicht nur die einfache Handhabung, sondern auch die Tatsache, dass es zelleigene Reparaturmechanismen nutzt. Diese werden durch den Schnitt des Erbgutstrangs in Gang gesetzt und lassen sich verwenden, um ein Gen zu inaktiveren, einzelne Bausteine zu verändern oder auch größere DNA-Abschnitte einzufügen.
Grundsätzlich können nach dem Durchtrennen des DNA-Strangs zwei Wege beschritten werden. Sie hängen davon ab, ob zusammen mit der Genschere eine dem Zielort ähnliche DNA-Sequenz als Reparaturvorlage eingeschleust wird, die gezielt in das Erbgut der angesteuerten Zellen eingebaut werden soll. In der Pflanzenforschung werden mithilfe von CRISPR/Cas9 bisher vor allem einzelne Gene punktuell verändert oder deaktiviert. Allein dadurch eröffnet sich ein breites Spektrum an Möglichkeiten, relativ schnell Pflanzen mit neuen Eigenschaften zu generieren.
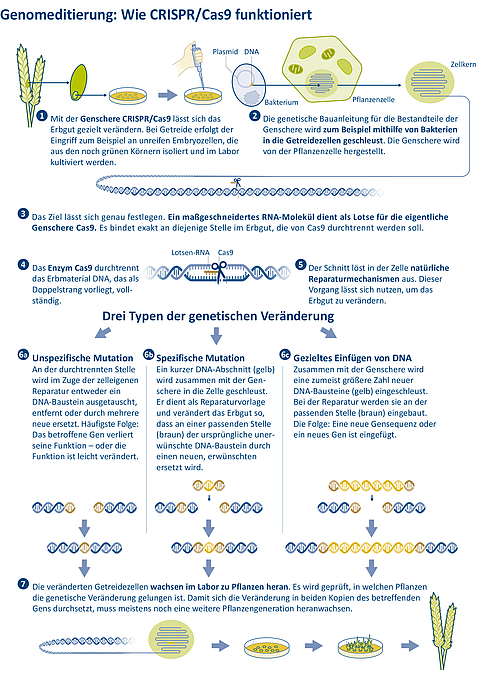
Abbildung 3: Funktionsweise der Genschere CRISPR/Cas9. Mit diesem Genomeditierungsverfahren lassen sich bestimmte Stellen im Erbgut präzise ansteuern und durchtrennen. Der dadurch ausgelöste Reparaturprozess lässt sich nutzen, um genetische Veränderungen zu erzeugen (Mutationen) oder ganze Gene einzufügen. Quellen: JKI/IPK | Gestaltung: Emde Grafik
Liegt keine Reparaturvorlage vor, erfolgt das Zusammenfügen der Bruchstellen unspezifisch. Die Zelle versucht, den Strang wieder zu verbinden. Dabei können kleine Fehler auftreten. Beispielsweise kommt es vor, dass einzelne Erbgutbausteine verloren gehen oder neue ergänzt werden. Diese kleinen Fehler sind bei der Anwendung der Genschere beabsichtigt. Denn auf diese Weise verliert das betreffende Gen seine Funktion und wird ausgeschaltet. Ein anderes Resultat kann eine leicht veränderte Genfunktion sein. Was nach dem gezielt angesetzten Schnitt im Erbgut geschieht, muss anschließend im Labor untersucht werden. Dieses Verfahren (nicht-homologe Rekombination) ist zwar nicht ganz spezifisch, trotzdem aber deutlich gezielter als Verfahren der klassischen Gentechnik oder der Mutagenesezüchtung, bei denen sich häufig vorher nicht festlegen lässt, an welcher Stelle im Genom eine Veränderung erfolgen soll (siehe Abbildung 3, 6.1).
Spezifischer ist die homologe Rekombination. Dabei wird mit der Genschere ein zusätzliches DNA-Fragment eingeschleust, das in das Erbgut eingebaut werden soll. Das DNA-Fragment ist an beiden Enden mit einer Sequenz versehen, die mit der Gen-Bausteinfolge an den Enden des gebrochenen Strangs übereinstimmt. Das führt dazu, dass die Zelle den durchtrennten DNA-Strang anhand dieser Vorlage reparieren kann. Bei der homologen Rekombination können entweder nur ein oder wenige Genbausteine ausgetauscht werden oder es wird ein ganzes Gen eingefügt. (siehe Abbildung 3, 6.2 und 6.3).
„Die Genomeditierung hilft uns in bisher nicht dagewesener Weise, die Funktion von Genen zu verstehen – und zwar in Kulturarten und nicht nur in Modellarten.“
So arbeiten andere Genscheren
Dass es Enzyme wie Cas gibt, die den Erbgutstrang durchtrennen können, ist schon länger bekannt. Die ersten solcher potenziellen Genscheren wurden bereits vor mehr als 40 Jahren entdeckt. Erst in jüngerer Zeit gelang es aber, derartige Enzyme programmierbar zu machen, also sie genau an den Ort zu leiten, an dem sie das Erbgut schneiden sollen.
Das CRISPR/Cas-System hat gegenüber anderen Genscheren einen entscheidenden Vorteil: Die Lotsen-RNA ist einfach herzustellen. Sie besteht lediglich aus etwa 20 Erbgutbausteinen, die sich im Labor leicht herstellen lassen. Für die Genscheren TALEN und für Zinkfinger-Nukleasen hingegen muss ein vollständiges Protein hergestellt werden, das die Stelle, an der das Erbgut geschnitten werden soll, festlegt. Das dauert länger, ist teurer und oft weniger effizient.
- Die Genschere TALEN basiert auf einem Protein, das bei Xanthomonas-Bakterien vorkommt und für diese Genschere umgebaut wird. TALEN steht für Transcription Activator-Like Effector Nuclease, auf Deutsch Transkription-Aktivator-artige Effektor-Nukleasen. Das Protein, das die zu schneidende Zielsequenz im Erbgut ansteuert, funktioniert sehr genau und lässt sich auch für längere Zielsequenzen programmieren.
- Auch mit Zinkfinger-Nukleasen lässt sich das Erbgut editieren. Sie bestehen aus dem Zinkfinger-Protein, das eine bestimmte Sequenz im Genom erkennt und einem Enzym, das den DNA-Strang durchtrennt: eine Nuklease. Das Zinkfinger-Protein muss in einem relativ aufwendigen Prozess künstlich hergestellt werden.
- Meganukleasen sind Genscheren, die auf natürlich vorkommenden Enzymen basieren, die entsprechend verändert werden. Sie sind zielgenauer als Zinkfinger-Nukleasen, weil sie längere Sequenzen erkennen. Ihre Anpassung an neue Zielsequenzen ist jedoch so kompliziert, dass Meganukleasen kaum in Forschung und Anwendung genutzt werden.
- Das genomische Verfahren Oligonukleotid gerichtete Mutagenese (ODM) wird in der Grundlagenforschung und der Pflanzenzüchtung eingesetzt. Hierbei werden kurze DNA-Abschnitte, Oligonukleotide, hergestellt und ins Erbgut geschleust. Sie binden an die vorgesehene Stelle und lösen dort eine sogenannte Fehlpaarung aus. Diese Unregelmäßigkeit aktiviert zelleigene Reparaturmechanismen, welche das eingeschleuste Molekül als Reparaturvorlage nutzen und die eingeschleuste Information ins Erbgut der Pflanze kopieren, ohne die fremde DNA einzubauen. Auf diese Weise lassen sich einzelne Erbgutbausteine austauschen und kurze Sequenzen einfügen oder löschen. Mit dem ODM-Prinzip wurden 1999 erste Kulturpflanzen genetisch verändert.
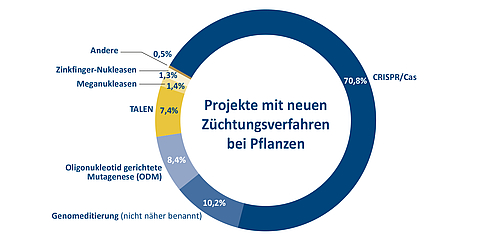
Abbildung 4: Anteil der verschiedenen Genomeditierungsverfahren bei Projekten zur Entwicklung von Pflanzen mit modifizierten oder neuen Merkmalen. Die Übersicht über die insgesamt 426 Projekte weltweit wurde für einen Bericht des Joint Research Centre der Europäischen Kommission erstellt. Quelle: Parisi, C., Rodrigeuz-Cerezo, E., Current and future market applications of new genomic techniques, Luxemburg, 2021 | Gestaltung: Emde Grafik
Wie sehr die CRISPR/Cas-Technologie mittlerweile die Pflanzenzüchtung dominiert, zeigt der Ende April 2021 veröffentlichte Bericht der Gemeinsamen Forschungsstelle (Joint Research Centre/JRC) der EU-Kommission über aktuelle und zukünftige Marktanwendungen neuartiger genomischer Techniken. Er bietet einen Überblick über bereits zugelassene genomeditierte Produkte bis hin zu Projekten im frühen Stadium der Forschung und Entwicklung, insgesamt sind es 426. Die Aufschlüsselung nach der jeweils angewendeten Technologie zeigt, dass mehr als 70 Prozent der Projekte auf der CRISPR/Cas-Methode beruhen. TALEN und ODM machen rund sieben beziehungsweise acht Prozent aus.
Veröffentlicht: Oktober 2021